健康食品・サプリメントのOEMメーカー、三生医薬株式会社(本社:静岡県富士市、代表取締役社長:今村 朗)は、2025年4月1日に施行された機能性表示食品の制度改正(SRのPRISMA2020準拠義務化)に対応し、届出受理実績のある「47原料・67訴求」の詳細リストを本日より公開しました。
本リストは、当社の機能性表示食品オウンドメディアにて、無料ダウンロード資料として入手可能です。
制度対応とスピードが求められる今、OEMパートナー選定のご参考としてぜひご活用ください。

▼制度対応は“選ばれる製品”づくりの第一歩
機能性表示食品制度において、2023年9月のガイドライン改正で「原則」とされたSR(システマティックレビュー)のPRISMA2020準拠が、2025年4月よりついに「義務化」されました。PRISMA2020準拠版のSRは受理実績が少なく、差し戻しの可能性も高いため、制度対応に強いOEMパートナーの存在が、商品化のカギを握ります。
三生医薬では、この制度改正にいち早く対応し、PRISMA2020に準拠し、かつ届出受理実績のある47原料・67訴求を整備し、新制度下で企画から製品化、届出までを一貫して支援できる体制を強化してまいりました。
▼PRISMA2020対応済み原料リスト(一部抜粋)
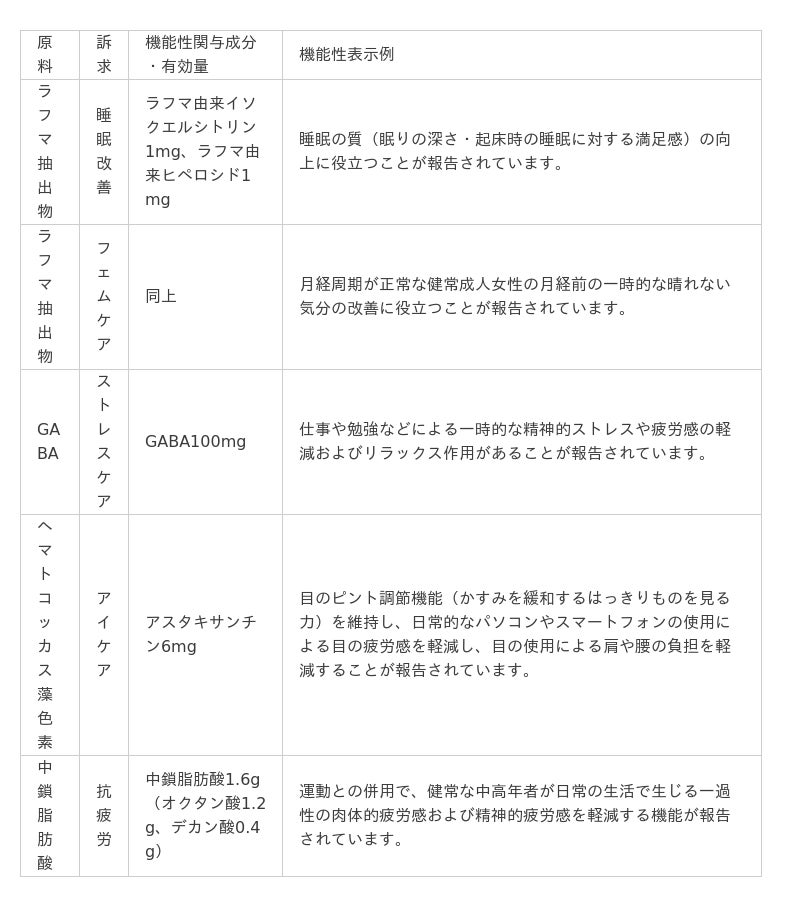
このほかにも、下記のとおり、幅広いヘルスクレームに対応した原料をラインナップしています。
詳細リストは、当社オウンドメディアに公開した以下のダウンロード資料でご確認いただけます。

PRISMA2020対応済み 詳細リスト

※本リリースに掲載した原料以外にも、PRISMA2020に準拠したSRで届出中、SR作成中などの原料もありますので、お気軽にお問い合わせください。
▼執行役員 マーケティング本部長 杉浦 瑞枝のコメント
「今回の制度改正は、私たちOEMメーカーにとっても、単なる“対応”ではなく、“対応の質”が問われる時代の到来を示しています。三生医薬は、これまでに蓄積してきた届出実績と製剤開発の知見を活かし、制度の変化をお客様のチャンスに変える支援に取り組んでいます。制度理解、スピード、そして実行力。この3つを兼ね備えたパートナーとして、“選ばれる製品づくり”を共に推進してまいります。」
▼商品開発・制度対応のご相談はこちら
OEM企画提案は無料です。構想段階のご相談から、製剤設計、試作・量産、届出まで、ワンストップで支援いたします。また、4月1日より必要になった「自己点検」や「届出様式変更」など制度変更への対応に関するご相談も歓迎です。
お問い合わせフォーム
▼制度改正を、製品価値向上のチャンスに
制度対応は、単なる“ルールの順守”がゴールではなく、“消費者に信頼される製品を届ける”ためのスタート地点です。三生医薬は、制度対応力と開発実行力を融合したOEMパートナーとして、企画から製品化、届出までを一貫して支援します。
2025年は、変化の大きい時代だからこそ、確かな裏付けとスピードが強く求められます。
貴社の「次の一歩」を、私たちが後押しします。
▼メディア関係者のお問い合わせ窓口
三生医薬株式会社広報担当 藤作(ふじさく)
Email: kenichi.fujisaku@sunsho.co.jp
▼三生医薬株式会社について
【所在地】静岡県富士市厚原1468【代表者】代表取締役社長 今村 朗
【設 立】1993年11月
【資本金】1億2,338万9千円
【売上金】250億800万円(2024年3月期)
【従業員】700名(2025年1月現在)
【事業内容】健康食品、医薬品、一般食品、雑貨等の企画・開発・受託製造
【会社HP】https://www.sunsho.co.jp










































